
Почему тела окрашенны?
Давно были известны человеку красители — с древних времен. Добывали их из самых разнообразных природных продуктов и, конечно, представления не имели о том, почему одни из них красят в красный цвет, а другие — в синий. Сейчас созданы сотни искусственных дешевых красителей для тканей и других материалов. Производство органических красителей и полуфабрикатов — одна из важных отраслей промышленности органического синтеза.
Что такое цвет?
Известно, что обычный свет — это поток электромагнитных волн. Любая волна имеет длину (расстояние между соседними максимумами), имеют длину и волны света. Белый солнечный свет — смесь потоков самых различных длин волн. Разделить эти потоки можно, пропустив пучок света через призму. Такие опыты проводил еще Ньютон, известны такие явления и в природе — кто не видел радуги?
Итак, волны разной длины воспринимаются глазом как свет разных цветов. Весь видимый свет умещается в очень небольшой интервал длин волн — от 400 до 760 нм. Если выделить, например, волны с длиной от 565 до 492 нм, то они покажутся глазу светом зеленого цвета. Обрамляют короткий видимый интервал слева, со стороны больших длин волн, инфракрасные лучи, справа — ультрафиолетовые. И те, и другие невидимы для человеческого глаза.
Цвета, а вернее лучи света могут складываться и вычитаться. Так, все цвета радуги в сумме, накладываясь один на другой, дают белый цвет. А если из белого света вычесть фиолетовые лучи, то оставшиеся волны дадут желтый цвет.
Почему тела окрашенны?
Наверное, теперь можно ответить на вопрос: почему песок желтый, морковь красная? Просто различные тела поглощают из белого света, который на них падает, некоторые определенные лучи, а остальные отражают. Например, лимон потому желтый, что он поглощает фиолетовые лучи и отражает все остальные.
А если предмет не окрашен, имеет белый цвет? Это значит, что он в равной степени отражает все падающие на него лучи. Черный предмет поглощает весь свет. Наконец, серые предметы в равной мере поглощают все лучи, но поглощают не полностью.
Все сказанное относится и к индивидуальным химическим соединениям, и к растворам. Например, раствор марганцовокислого калия имеет фиолетовую окраску. Это значит, что он поглощает желтые и зеленые лучи света, в какой-то степени и все другие, кроме фиолетового. А вот оранжевый раствор двухромовокислого калия «вычитает» из белого света в основном синие лучи. Оба вещества поглощают еще ультрафиолетовый свет, но это не изменяет их окраску
Повторим опыт Ньютона со светом: пучок солнечного света пропустим через стеклянную призму, развернем па экране в искусственную радугу. А теперь нальем в стакан раствор какого-нибудь окрашенного вещества и будем перемещать стакан поперек отдельных цветов радуги. Если смотреть на просвет, то окажется, что какие-то лучи поглощаются, и в этих местах стакан с раствором станет как бы непрозрачным темным цилиндром. Другие же лучи проходят через раствор почти не ослабленными. Почему же вещества поглощают свет? И почему каждое вещество «выбирает» только лучи определенного цвета?
Поглощение обусловлено взаимодействием световых волн с молекулами вещества. На рубеже нашего века Планк и Эйнштейн установили, что всякое излучение испускается и поглощается определенными мельчайшими порциями, квантами, а свет имеет свойства не только волн, но и частиц (они были названы фотонами). Чем меньше длина электромагнитных волн, тем больше энергия отдельного кванта света. Позже, когда была создана теория строения атома, стало ясно, что в любом атоме или молекуле электроны могут занимать лишь вполне определенные орбитали, каждой из которых соответствует строго определенный запас энергии. Когда на вещество падает свет, кванты света придают электрону дополнительную энергию, электрон перескакивает на более высокий энергетический уровень. Для наблюдателя это означает, что квант света поглощен веществом.
Особенность атомов и молекул как квантовых систем состоит в том, что поглощение света происходит при выполнении одного условия: энергия кванта должна точно соответствовать разности энергий электрона на исходной, низшей орбитали (или — на нижнем энергетическом уровне), и на конечной орбитали (или — на верхнем уровне). Если такого совпадения нет, то свет не поглощается. При совпадении этих энергий электрон возбуждается и поднимается за счет поглощенной энергии на более высокий энергетический уровень. Обычно электрон недолго задерживается на верхнем, возбужденном уровне. Поглощенная энергия освобождается молекулой в другой форме, чаще всего — в виде тепла (тело нагревается), реже запасенная энергия тратится на какую-нибудь химическую реакцию; здесь мы вступаем в область фотохимии. Иногда поглощенная энергия выделяется снова в виде излучения — наблюдается люминесценция.
Чем же определяется окраска
вещества? Подавляющее большинство органических соединений бесцветно.
Таковы, к примеру, насыщенные углеводороды. Связывание атомов в них
осуществляется ![]() -электронами,
которые прочно удерживаются на своих энергетических уровнях, и для того
чтобы их «раскачать», нужно потратить много энергии. Значит, кванты
света, который будут поглощать такие углеводороды, должны содержать
большой запас энергии. Поэтому не удивительно, что предельные
углеводороды поглощают только в ультрафиолетовой области, т. е. такой
свет, кванты которого несут большую энергию. Вообще осе органические
соединения поглощают ультрафиолетовые лучи.
-электронами,
которые прочно удерживаются на своих энергетических уровнях, и для того
чтобы их «раскачать», нужно потратить много энергии. Значит, кванты
света, который будут поглощать такие углеводороды, должны содержать
большой запас энергии. Поэтому не удивительно, что предельные
углеводороды поглощают только в ультрафиолетовой области, т. е. такой
свет, кванты которого несут большую энергию. Вообще осе органические
соединения поглощают ультрафиолетовые лучи.
«Раскачать»
![]() -электроны
легче, поэтому многие соединения с двойными связями поглощают в той
области ультрафиолетового света, которая близка к видимой. Еще легче
«на подъем» электроны в сопряженных непредельных соединениях. Каротин —
вещество, содержащее большое число сопряженных двойных связей, — окрашен
в желтый цвет.
-электроны
легче, поэтому многие соединения с двойными связями поглощают в той
области ультрафиолетового света, которая близка к видимой. Еще легче
«на подъем» электроны в сопряженных непредельных соединениях. Каротин —
вещество, содержащее большое число сопряженных двойных связей, — окрашен
в желтый цвет.
Легко проследить, как происходит углубление окраски, на примере соединений, содержащих цепь сопряженных двойных связей с фенильными кольцами на концах.
Разные теории
Первую теорию цветности органических соединений предложил в 1876 г. немецкий ученый О. Витт. Он считал, что в окрашенных соединениях (хромогенах) содержится ненасыщенная группировка — хромофор. К хромофорам Витт относил двойную связь, азогруппу —N—N—, азометиновую группу —CH=N—, нитрозогруппу —NO, нитрогруппу —NO2, а также карбонил СО. Было подмечено, что некоторые функциональные группы сами не придают цвет соединению, но при наличии в нем хромофора углубляют окраску, так что вещество приобретает красящие свойства. К таким — ауксохромным — группам были отнесены гидроксогруппа —ОН, аминогруппа —NH2 и ее производные, например —N(CH3)2.
Итак, вот как, например, по Витту, можно «расчленить» такое окрашенное соединение:

Хромофорно-ауксохромную теорию цветности дополнила так называемая хиноидная теория. Согласно этой теории, во всех окрашенных соединениях присутствует хиноидный фрагмент:
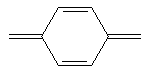
В дальнейшем мы увидим что, действительно, структуры многих красителей включают этот фрагмент.
Какие бывают красители?
Основное применение органических красителей — окрашивание различных материалов, волокон, пряжи, Тканей — натуральных и синтетических, а также бумаги, изделий из кожи.
Иметь цвет — этого еще недостаточно, чтобы органическое соединение стало красителем. Одно из важнейших условий — само красящее вещество должно прочно связываться с окрашиваемым материалом.
Самый простой способ крашения — применение прямых красителей. Хлопчатобумажные и полушерстяные ткани просто погружают на какое-то время в водный раствор красителя. Гидроксилы и аминогруппы красителя образуют водородные связи с гидроксилами целлюлозы, что и удерживает краситель на материале.
Один из первых прямых красителей был получен 1884 г. Беттигером из бензидина и нафтионовой кислоты. Он имеет, как, впрочем, многие красители, довольно сложную, громоздкую формулу:
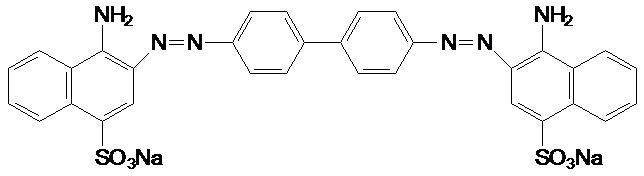
Как видим, в состав этого красителя, называемого «конго красный», входят сульфогруппы. Они способствуют растворению вещества в воде. Многие красители получают из составляющих их соединений прямо на ткани.
Весьма обширно семейство азокрасителей. Они поучаются реакцией азосочетания. Сначала из ароматического амина приготовляют действием азотистой кислоты соль диазония. Затем этой солью действуют на фенол или другой ароматический амин. Идет замещение водорода в пара-положении к диметиламиногруппе, и получается азокраситель:

Так получают прямые красители, например, конго красный; можно проводить азосочетание и прямо на ткани.
Рассмотрим на простейшей модели — аналоге метилового оранжевого (уберем из него сульфогруппу) — оптические свойства красителя. Почему это соединение окрашено?
Во-первых, как мы говорили, у него богатая система сопряжения: фенильное кольцо, двойная связь N=N, второе фенильное кольцо, диметиламиногруппа со свободной парой электронов. Далее, можно представить себе, что для этого соединения возможна хиноидная структура. Это изображается резонансом двух структур («обоюдная» стрелка). Хиноидную структуру можно получить и в явном виде, присоединяя к красителю протон:
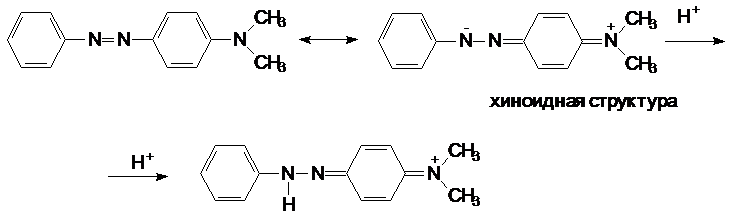
Действительно, в кислой среде окраска метилового оранжевого изменяется от желтой до красной — более ярко выраженная хиноидность углубляет цвет. На этом свойстве и основано применение метилового оранжевого в качестве кислотно-основного индикатора.
Азокрасители — далеко не единственные, получаемые прямо на ткани. Широко применяют такой способ. На волокна наносят смесь анилина, солянокислого анилина, бертолетовой соли или бихромата калия, а также катализатор (например, соль меди или ванадия). После этого ткань обрабатывают водяным паром. Образуется прекрасный краситель — анилиновый черный, представляющий собой продукт окисления анилина. Формула этого красителя окончательно еще не установлена, и мы не будем приводить здесь предполагаемые варианты.
Тот же принцип — окисление при крашении — применяется и в случае широко известного индиго. Перед крашением индиго восстанавливают (например, цинковой пылью) в так называемое белое индиго — неокрашенное, растворимое в щелочи вещество. Затем ткань пропитывают таким слабощелочным раствором и выносят на воздух. При окислении образуется нерастворимое синее индиго, которое и есть краситель.
Ещё один вид красителей, получаемых прямо на ткани, — протравные. Сначала ткань протравливают раствором соли металла, затем пропитывают раствором органического вещества, которое образует с этим металлом устойчивый, красиво окрашенный комплекс. Наиболее известный краситель такого типа — ализарин — дает с алюминием красный лак, с хромом — темно-фиолетовый.
Любому школьнику, начавшему заниматься химией, знаком фенолфталеин — индикатор на щелочь. Получают фенолфталеин, нагревая фталевый ангидрид и фенол с серной кислотой. Это очень любопытное вещество. В нейтральной и кислой среде оно бесцветно. Но стоит прибавить к его раствору немного щелочи, как появляется малиновое окрашивание. Причины этого нам уже известны — образование хиноидной структуры.
Если в той же реакции конденсации вместо фенола взять двухатомный фенол резорцин, получится исключительно красивый, флуоресцирующий желтым с зеленоватым оттенком краситель, названный флуоресценном.
Вообще, соединения, содержащие у одного атома углерода три фенильных кольца, представляют собой обширную группу трифенилметановых красителей. Они получаются конденсацией ароматических альдегидов с ароматическими же аминами. Сюда относятся известные красители малахитовый зеленый, фуксин, кристаллический фиолетовый. В их структурах легко выявляется хиноидный фрагмент и есть возможность для делокализации заряда
Химия и свет
Мы уже упоминали, что если молекула поглощает квант энергии, один из путей освобождения от этой энергии состоит в химическом превращении. Избыточная энергия приводит к активации молекулы, ее переходу в возбужденное состояние; теперь молекула может вступать в реакции, которые для нее недоступны в ее основном, невозбужденном состоянии.
Некоторые фотохимические реакции всем хорошо известны — это фотография. Другой также всем хорошо известный, хотя и гораздо более сложный фотохимический процесс — это фотосинтез. Здесь светочувствительной молекулой служит хлорофилл. Возбуждаясь квантом света, он становится хорошим донором электронов и «запускает» сложную цепь окислительно-восстановительных реакций, которые в конечном счете приводят к окислению воды с образованием молекулярного кислорода и восстановлению СО2 до углеводов.
В фотохимических процессах свет возбуждает молекулу и делает ее способной к химическим превращениям. Однако возможна и обратная ситуация: темновая химическая реакция сама приводит к образованию возбужденных продуктов. А мы уже отмечали, что возбужденная молекула может по–разному использовать заключенную в ней избыточную энергию. В частности, возбуждение может быть высвечено в виде кванта света. Такие процессы называют хеми-люминесценцией. Если краситель люминол растворить в щелочи и прилить к этому раствору перекиси водорода и феррицианида, то в колбе возникает голубое свечение настолько интенсивное, что при этом свете можно читать книжку. Свечение возникает оттого, что люминол, окисляясь, образует возбужденные продукты, теряющие избыточную энергию в виде излучаемого света. В природе такие процессы тоже хорошо известны. Это свечение многих морских организмов и насекомых-светлячков.
•
•
Copyright © 2005 - 2007 Webmaster